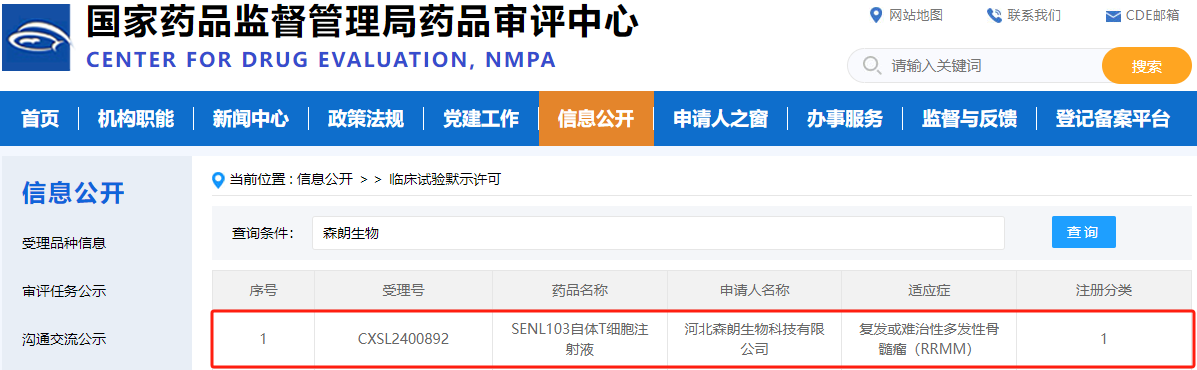
2025年3月19日,國家藥品監督管理局藥品審評中心(CDE)官網顯示,河北森朗生物科技有限公司自主研發的“SENL103自體T細胞注射液”新藥臨床試驗(IND)申請正式獲得默示許可(受理號:CXSL2400892),其適應癥為復發或難治性多發性骨髓瘤(RRMM)。
SENL103自體T細胞注射液是森朗生物自主研發的具有完全自主知識產權的Ⅰ類新藥,是基于森朗生物納米抗體CAR篩選和驗證平臺開發的創新型CAR-T產品,將為復發或難治性多發性骨髓瘤患者帶來新的希望和治療選擇。
關于森朗生物
河北森朗生物科技有限公司成立于2016年1月,位于石家莊市國際生物醫藥園,是專注于創新型免疫細胞治療藥物研發生產及臨床轉化的高科技生物醫藥企業,已有多款first-in-class/first-in-safe的產品處于臨床試驗階段。森朗生物擁有多個獨創性的核心技術平臺,包括快速納米抗體CAR篩選和驗證平臺、高效質粒病毒制備平臺、高性價比CAR-T細胞制備平臺等;產品管線布局廣泛,包括自體CAR技術、通用CAR技術,適應癥覆蓋血液腫瘤和自身免疫類疾病。森朗生物已與北京大學人民醫院等多家國內知名臨床機構合作,成功救治了上千例晚期癌癥患者。公司創新型產品“SENL101自體T細胞注射液”可突破性用于CD7陽性T細胞起源的血液淋巴系統惡性疾病治療,獲得FDA孤兒藥資格認定,填補了國際空白,目前處于I期臨床試驗階段。


